センサ
- イオン電極のはなし/2001.3
- ORP(酸化還元電位)について/2001.4
- 温度センサ:サーミスタ/2006.11
- 温度センサの選択と設置(1)/1998.4
- 温度センサの選択と設置(2)/1998.5
- カルマン渦の話/1994.3
- コアレス電流センサ/2000.10
- CT(Current Transformer)について(1)/2008.07
- CT(Current Transformer)について(2)/2008.08
- ジルコニア式酸素濃度計の話/1994.7
- セルシン/2002.12
- 測温抵抗体の導線方式/2003.4
- 電気伝導率計のはなし/2000.12
- 電磁濃度計のはなし/2001.1
- 熱電対と熱電対信号変換器(1)/1998.6
- 熱電対と熱電対信号変換器(2)/1998.7
- 熱電対・変換器間の導線による温度測定誤差と対策/2012.10
- pH計(1)/2000.8
- pH計(2)/2000.9
- pH計(3)/2000.11
- ポーラログラフについて/2001.5
- 溶存酸素計のはなし/2001.2
- 流速計による流量測定方法/1996.3
- ロータリエンコーダ/2003.1
- ロードセルの仕組みと使い方/2018.1
エムエスツデー 2001年4月号
ORP(酸化還元電位)について
酸化還元反応とは
酸化とは、物質、分子または原子が電子を失う過程をいい、還元とは、逆に物質、分子または原子が電子を得る過程をいいます。
ある物質の酸化型と還元型の混合系を酸化還元系と呼び、この系の中で、酸化反応と還元反応は常に可逆的に起こります。自然界で起こる多くの物質変化において、この酸化還元反応は最も基本的で重要な反応といえます。
【酸化還元反応の例】
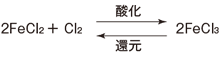
ORP(酸化還元電位)ってなに?
酸化還元可逆平衡状態にある水溶液に標準水素電極と白金電極を挿入すると、1つの可逆電池が構成され、その溶液の酸化還元平衡状態に応じて一定の電位差が検出されます。この電位差のことを酸化還元電位(Oxidation−Reduction Potential)と呼び、英語の頭文字をとってORPと表現します。
酸化還元電位は次式で表すことができます。
|
この式は、Ehは〔Ox 〕が高くなれば高くなり、〔Red 〕が高くなれば低くなることを意味しています。また、〔Ox 〕/〔Red 〕に左右されるということから、酸化型と還元型の絶対量ではなく、比に依存していることも意味しています。これらのことから、酸化還元電位は、その溶液が酸化傾向にあるのか還元傾向にあるのかを判断する指標とはなり得ますが、濃度を特定する性格のものではないことがわかります。ただし、酸化還元系の変化に対する抵抗性は、高濃度溶液ほど大きくなります。
実際のORPの測定
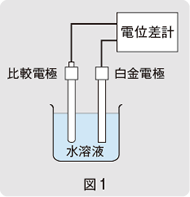 ORPの測定には、pH計のmVレンジまたは同等の入力抵抗を有する電位差計と白金電極および比較電極を用います。図1に示すように測定しようとする水溶液に両電極を挿入し、得られる電位差を読み取ります(最近では、ORP測定用電極として、白金電極と比較電極を一体にした複合電極が広く用いられています)
ORPの測定には、pH計のmVレンジまたは同等の入力抵抗を有する電位差計と白金電極および比較電極を用います。図1に示すように測定しようとする水溶液に両電極を挿入し、得られる電位差を読み取ります(最近では、ORP測定用電極として、白金電極と比較電極を一体にした複合電極が広く用いられています)
この場合に使用される比較電極は、先に述べた標準水素電極とは異なり、一般に銀/塩化銀電極やカロメル電極であるため、得られる電位差は正しいEh の値ではないので注意が必要です。正しいEh の値を求めるには、使用した比較電極と標準水素電極の間の電位差(表1参照)を、測定した電位差に加えます。
表1
| 温度 [℃] |
標準水素電極と各種比較電極との電位差[mV] | ||
| 飽 和 カロメル電極 |
飽 和 塩化銀電極 |
3.3mol/L 塩化銀電極 |
|
| 0 | 260 | 223 | 224 |
| 5 | 257 | 218 | 221 |
| 10 | 254 | 214 | 217 |
| 15 | 251 | 209 | 214 |
| 20 | 248 | 204 | 210 |
| 25 | 244 | 199 | 206 |
| 30 | 241 | 194 | 203 |
| 35 | 238 | 189 | 199 |
| 40 | 234 | 184 | 196 |
| 45 | 231 | 179 | 192 |
| 50 | 227 | 173 | 188 |
| 55 | 224 | 168 | 185 |
| 60 | 220 | 162 | 181 |
たとえば、飽和塩化銀比較電極を用いて25℃の水溶液を測定した際の測定値が450mVだった場合、Eh =450+199=649〔mV〕になります。
【柳田 芳紀:東亜ディーケーケー(株) 生産センター】

