2000-2001年計装豆知識
- インターネットとイントラネット(1)/2001.12
- LONWORKSについて/2001.11
- 計装配線用電線・ケーブルについて/2001.9
- 電磁弁について/2001.8
- 汎用インバータについて/2001.7
- 接地について/2001.6
- ポーラログラフについて/2001.5
- ORP(酸化還元電位)について/2001.4
- イオン電極のはなし/2001.3
- 溶存酸素計のはなし/2001.2
- 電磁濃度計のはなし/2001.1
- 電気伝導率計のはなし/2000.12
- pH(ピーエッチ)計(3)2000.11
- コアレス電流センサ/2000.10
- pH(ピーエッチ)計(2)/2000.9
- pH(ピーエッチ)計(1)/2000.8
- 調節弁の基礎知識(3)/2000.7
- 調節弁の基礎知識(2)/2000.6
- 調節弁の基礎知識(1)/2000.5
- 電気機械器具の防爆構造(2)/2000.4
- 電気機械器具の防爆構造(1)/2000.3
- CC-Link/2000.2
- DeviceNet(デバイスネット)/2000.1
エムエスツデー 2001年3月号
イオン電極のはなし
イオン電極の種類
イオン電極とは、溶液中に含まれる特定のイオンの濃度に対応した電極電位を発生する電極です。イオン電極には表1に示すような種類がありますが、その構造からガラス膜型、固体膜型、液膜型、隔膜型に分類されます。具体的な測定範囲はイオン電極の種類によって異なりますが、共通して低濃度から高濃度までの広い範囲のイオンの濃度を測定できるのが特徴です。イオン電極は選択的に特定のイオンだけに応答して、そのイオンの濃度を測定しますが、共存するほかのイオンの影響を受ける場合があります。共存することにより測定に影響し、実測値に誤差を与えるイオンを妨害イオンといいます。妨害イオンはイオン電極の性質により決まるため、電極それぞれによって異なります。その主な妨害イオンを表1に示します。妨害イオンは、共存不可のもの、ある一定以上の濃度で妨害するものなど様々です。したがってイオン電極で測定する場合は、どのようなサンプルでも測定できるわけではなく、測定対象とする液体中に妨害となるイオンがどの程度共存するか事前に把握してから行うことが必要です。
表1 イオン電極の種類
| 測定イオン | 形 状 | 測定範囲(mg/L) | 主な妨害イオン |
| NA+ | ガラス膜 | 2.3~23,000 | K+、NH4+ |
| Cl- | 固体膜 | 1~35,000 | S2-、I-、Br- |
| Br- | 固体膜 | 0.8~80,000 | S2-、I- |
| I- | 固体膜 | 0.013~127,000 | S2- |
| CN- | 固体膜 | 0.003~26 | S2-、I- |
| Cd2+ | 固体膜 | 0.01~1,120 | Hg2+、Ag+、Cu2+ |
| Cu2+ | 固体膜 | 0.06~630 | Hg2+、Ag+ |
| Ag+ | 固体膜 | 0.1~108,000 | Hg2+ |
| S2- | 固体膜 | 0.3~32,000 | なし |
| F- | 固体膜 | 0.01~19,000 | OH- |
| K+ | 液膜 | 0.39~3,900 | NH4+ |
| Ca2+ | 液膜 | 0.4~40,000 | Pb2+、Zn2+ |
| NO3- | 液膜 | 0.62~62,000 | I-、Br-、NO2- |
| NH4+ | 隔膜 | 0.09~1,800 | 揮発性アミン類 |
| CO2 | 隔膜 | 1.3~132 | 揮発性弱酸 |
イオン電極の測定原理と測定方法
イオン電極の電極電位Eは式(1)で表せます。
E = E0 +(2.303RT/nF )log a
…(1)
E0 :基準電位、R :気体定数、F :ファラデー定数、n
:測定イオンの価数、T :測定時の絶対温度、a :イオンの活量 注)
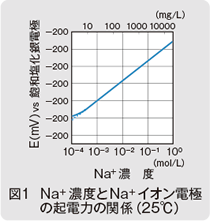
測定対象のイオンの価数n が+1で、温度が25℃の場合、式(1)に数値を代入して計算すると、次式が得られます。
E = E0 + 59.16 × log(a)…(2)
式(2)から分かるように、測定対象イオンの活量が10倍になると、電極電位は59.16mV増加します。イオン濃度と電極電位の関係の一例を図1に示します。
イオン電極による測定は図2に示すような構成で行われ、測定するにはイオン電極と対になる比較電極が必要です。これらを一体にしたのが図3に示すイオン複合電極です。
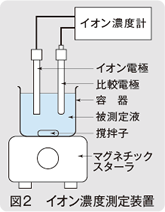
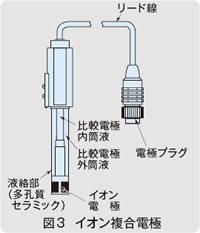
イオン電極は、そのまま被測定液に入れれば測定できるものではなく、まず標準液と専用のイオン濃度計(測定回路)を用いて校正を行っておく必要があります。校正後は、被測定液にイオン電極を入れ、同じイオン濃度計を用いてイオン濃度を直読して、測定することができます。
注)活量:イオンの活量(a )とイオン濃度(c )との間には、a = fc の関係があります。ここにf は活量係数と呼ばれ、低濃度では1ですが、高濃度になるほど、イオンの相互干渉のため、小さい値をとります。
【山里 昌春:東亜ディーケーケー(株) 商品開発部】

