規格/標準
- 技術輸出管理/2021.4
- IECExスキーム/2007.4
- ISO14000/2005.4
- IPコード/2003.7
- R&TTE指令について −CEマーキング−/2014.7
- RE指令について/2017.10
- 安全保障輸出管理における「該非判定」について/2008.6
- EMC規格について/2011.10
- EMC指令 −CEマーキング−/2010.4
- WEEE指令とRoHS指令/2005.1
- ATEX指令 −CEマーキング−/2010.7
- SI単位の話(1)/1995.3
- SI単位の話(2)/1995.4
- SI単位の話(3)/1995.5
- NEMA規格の電気機器用容器/2003.12
- エム・システム技研の環境保全への取組(1)/2008.4
- エム・システム技研の環境保全への取組(2)/2008.5
- 汚染度(Pollution Degree)/2009.10
- 改正RoHS(RoHS2)指令/2013.10
- 改正RoHS(RoHS2)指令[6物質から10物質へ]/2019.1
- 機能安全とIEC規格61508について(1)/2007.12
- 機能安全とIEC規格61508について(2)/2008.1
- 機能安全とIEC規格61508について(3)/2008.2
- 機能安全とIEC規格61508について(4)/2008.3
- 技術の輸出管理/2021.4
- グリーン調達の現状(1)− RoHS指令からREACH規則まで −/2009.7
- グリーン調達の現状(2)− RoHS指令からREACH規則まで −/2009.8
- CEマーキング/1995.2
- CEマーキング/2005.5
- CEマーキング(1)/2014.1
- CEマーキング(2)/2014.4
- CEマーキングに関するEU指令の改正について/2016.7
- 湿度の計量単位/1995.12
- CBスキーム/2006.3
- 設置カテゴリ(Installation Category)/2009.9
- タイプ“n”防爆構造について(1)/2009.5
- タイプ“n”防爆構造について(2)/2009.6
- 低圧避雷器(SPD)の性能試験規格JIS C5381-11について/2019.10
- 低電圧指令 −CEマーキング−/2010.1
- 電気機械器具の防爆構造(1)/2000.3
- 電気機械器具の防爆構造(2)/2000.4
- ノンインセンディブ規格(NON-INCENDIVE)/1998.1
- ノンインセンディブ防爆規格/2009.1
- 濃度の計量単位/1995.11
- パネル計器の裏側の感電保護/2007.10
- 舶用電気機器の船級協会型式承認/2013.4
- 白金測温抵抗体のJIS規格/2008.11
- 避雷関連のJIS規格について/2006.1
- 避雷器の分類/2011.1
- 紛争鉱物規制と米国再輸出規制/2017.7
- 米国の規制 FCCについて/2018.4
エムエスツデー 1995年11月号
濃度の計量単位
本年3月から5月にかけて、本欄にSI単位の話を連載しました。今回は、濃度の単位について説明します。
まず、新計量法における濃度の単位を表に示します。以下この順で説明します。
新計量法における濃度の単位
| 分類 | 単位 | 換算または注 |
| SI単位および これに準ずる単位 |
モル毎立方メートル(mol/m3) モル毎リットル(mol/l) 注) キログラム毎立方メートル(kg/m3) グラム毎立方メートル(g/m3) グラム毎リットル(g/l) 注) |
1 mol/l= 103 mol/m3 1g/m3=10-3kg/m3 1g/l=1kg/m3 |
| 一般に使用が 認められる 非SI単位 |
質量百分率(%) 質量千分率(‰) 質量百万分率(ppm) 質量十億分率(ppb) 体積百分率(vol %または%) 体積千分率(vol ‰または‰) 体積百万分率(vol ppmまたはppm) 体積十億分率(vol ppbまたはppb) ピーエッチ(pH) |
|
| 猶予期間後 法定計量単位から 削除される単位 |
規 定(N) | 1997年10月削除 |
注)リットルはlのほか、Lも可
1)モル濃度(mol/m3など)
モル毎立方メートルの新計量法における定義は、“物質1立方メートル中に、ある成分1モルを有する濃度”です。ここでいう“物質”とは、液体、気体、固体、いずれでもよいわけですが、液体の場合は“物質”を溶液、“成分”を溶質(溶液中に溶かされている物質)と読みかえるとわかりやすいでしょう。
ところで、モルはSI単位の基本単位の1つであり、計量法における定義は、“0.012キログラムの炭素12の中に存在する原子の数と等しい数の要素粒子または要素粒子の集合体で構成された系の物質量”となっています。一読しただけでは意味がわかりにくいでしょうが、一般には原子量または分子量の数値にグラムをつけて表した量と考えれば結構です。なお、上記の原子の数は、およそ6.022×10 23です。これをアボガドロ定数といい、物理化学における基礎定数の1つです。
2)質量濃度(kg/m3など)
キログラム毎立方メートルの定義は、“物質1立方メートル中に、ある成分1キログラムを有する濃度”です。“成分”の単位がモルからキログラムに変わった以外は、モル濃度と同じです。
3)質量分率(%など)、体積分率(vol%または%など)
これはとくに説明の必要はないでしょう。
4)ピーエッチ(pH)
ピーエッチの定義は、“モル毎リットルで表した水素イオン濃度の値に、活動度係数を乗じた値の逆数の常用対数”です。
この定義を式で表すと下記のようになります。
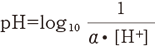
ただし、α は活動度係数、[H+]はモル/lで表した水素イオン濃度です。しかし、このα を測定することは容易ではありません。そのため、特定の溶液のpHをこの定義に基づいて設定し、これを基準としてpH計の目盛を校正しています。この特定の溶液をpH標準液といい、JISでは6種類が規定されています。
5)規定(N)
規定の定義は、“1立方メートル中に、1000モルをその価数で除した物質量の溶質を含有する溶液の濃度”となっています。
この定義を式で表すと下記のようになります。
N=103・C/Z
ここでNは規定、Cはmol/m3で表した酸またはアルカリ液の濃度、Zはその価数です。価数というのは、酸またはアルカリが、1分子の中にもつ水素イオンまたは水酸基イオンの数のことです(例:HCl、NaOHは1価、H2SO4は2価)。

